Глава 7
Хлор. «Кто тут главный? Я тут главный!»
Наш следующий герой — любимец учебников по химии и заданий ЕГЭ, «звезда» группы галогенов — хлор.
Элемент хлор располагается в 3 периоде VIIA группе периодической системы Д. И. Менделеева. Атом хлора имеет в своем составе 17 протонов и, соответственно, 17 электронов, а вот число нейтронов варьируется. В природе наиболее широко распространены изотопы с массовыми числами 35 и 37 (массовое число = количество протонов + количество нейтронов). Исходя из процентного соотношения изотопов, относительную атомную массу хлора высчитали как равную 35,5. Этот момент необходимо помнить при решении задач.

На внешнем энергетическом уровне у атома хлора — 7 электронов. Принимая еще один электрон, атом приобретает степень окисления -1. Но у атома хлора, в отличие от «соседа сверху» — фтора, есть дополнительные орбитали, а именно — пять d-орбиталей. Хлор ведь в третьем периоде находится. Поэтому при определенных условиях электроны с р — и даже s-подуровней способны «перебегать» на d-орбитали и занимать там единолично «вакантные» места. Электроны — они ведь, как люди, в душе немного эгоисты. Каждому хочется иметь свою комнату, свое жизненное пространство. Одиночные электроны — возможность разнообразить степени окисления и образовать различные соединения с другими атомами.
Хлору проще принять один электрон, довести свой энергетический уровень до завершенности и получить степень окисления, равную — 1 (самая распространенная в соединениях). Хлор — сильный окислитель.

Возможные степени окисления для хлора: — 1 (принимает электрон), +1, +3, +5 и +7 (отдает свои электроны)
Молекулярный хлор состоит из двух атомов и представляет собой ядовитый газ желто-зеленого цвета с резким запахом, растворимый в воде. Значительно тяжелее воздуха. Легко сжижается, ведь его температура кипения всего — 34 градуса. Кстати слово «хлор» с греческого языка переводится как «зеленый».
Получение хлора
По традиции рассмотрим отдельно лабораторные и промышленные способы получения.
Впервые хлор удалось получить немецкому химику Карлу Шееле в 1774 году путем воздействия соляной кислоты на минерал пиролюзит (оксид марганца (IV)). Шееле заметил, что образовавшееся вещество обладает отбеливающими свойствами и имеет запах царской водки. Помимо способа Шееле в лаборатории хлор получают по реакции соляной кислоты с каким-нибудь сильным окислителем, например, с перманганатом или дихроматом калия. Соляная кислота выступает в роли восстановителя.
В заводских условиях хлор получают электролизом раствора поваренной соли. Хлор собирается на аноде, на катоде восстанавливается водород, а в растворе остается гидроксид натрия.
Полученный хлор хранят в стальных баллонах.

Применение хлора
Для чего же мы его получали? А вот для чего:
— синтез хлорорганических соединений;
— отбеливание тканей, бумаги, картона. Правда, здесь есть один нюанс: отбеливает не сам хлор, а хлорноватистая кислота, которая образуется после растворения хлора в воде. Об этом мы еще поговорим;
— обеззараживание воды;
— производство неорганических соединений (соляная кислота, хлориды металлов, удобрения).
Хлор сам по себе очень токсичен, да еще и тяжелее воздуха, первым делом поражает дыхательную систему человека, вызывая ожоги и удушье. Поэтому спецодежда, противогаз и перчатки — неотъемлемый атрибут для сотрудников на производстве. При внештатной ситуации на короткое время защититься от воздействия хлора поможет ткань, смоченная раствором сульфита или тиосульфата натрия.
Химические свойства хлора
1. Реакции с неметаллами
Хлор активно вступает в реакции с неметаллами, с водородом и вовсе — вплоть до взрыва. Но с углеродом, азотом, кислородом и благородными газами хлор непосредственно не реагирует!
2. Реакции с металлами
Хлор реагирует почти со всеми металлами и выступает в роли сильного окислителя, приобретая отрицательную степень окисления. При этом продуктом взаимодействия являются различные соли. Такой порядок характерен не только для хлора, а для группы галогенов вообще. Недаром «галоген» означает «рождающий соль».
3. Реакции со сложными веществами

В реакции с более электроотрицательным фтором хлор выступает как восстановитель (не окисляет, а окисляется сам)

Взаимодействие хлора со щелочью — классический пример реакций самовосстановления-самоокисления (диспропорционирования). Ух, неужели напечатала без ошибок, от букв аж в глазах рябит! Иначе говоря, хлор свою степень окисления одновременно и понижает, и повышает. Вид продукта реакции зависит от температуры раствора щелочи.
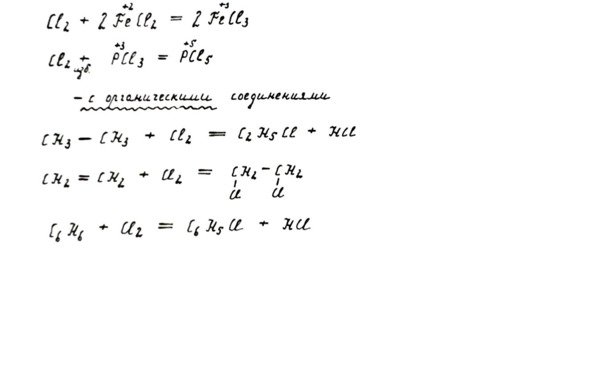
Раствор хлора в воде дает начало двум кислотам: соляной и хлорноватистой. Хлорноватистая кислота распадается, выделяя атомарный кислород — сильный окислитель, который и «отвечает» за отбеливающий эффект. Подобный механизм с выделением атомарного кислорода мы упоминали в главе про газ озон.
Каждый «выше стоящий» в группе галоген способен замещать собой в соединениях «ниже стоящий». Так на примерах реакций видно, что хлор вытесняет бром и йод из солей и становится на их место.
Отдельную группу составляют реакции хлора с органическими веществами. Здесь возможны вариации в зависимости от строения органической молекулы. Один из атомов хлора способен замещать атом водорода в насыщенных соединениях (где все связи одинарные). Молекула хлора может присоединяться целиком по кратным (двойным) связям. Хлор реагирует и с ароматическими соединениями.
Конец ознакомительного фрагмента.














